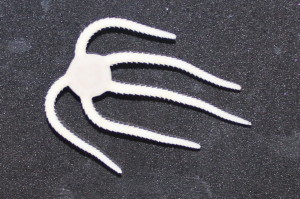
クモヒトデを分類する際には,体の中の微小骨片の観察が必要になる時があります.
今日はその観察法をレクチャーいたしましょう.

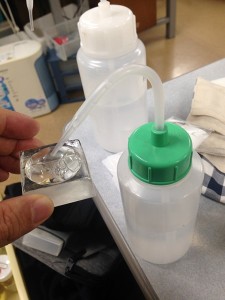
①まず時計皿に,観察したい部位を入れます.

②ハイターを,

③注入.

③軟組織が泡を立てて溶け始めます.
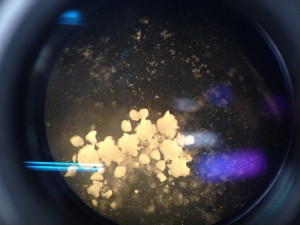
しばらく待つと,骨片が出てきました
④ピペットでハイターを取り除きます.
骨片を吸い込んでしまわないように注意.
ハイターは乾燥すると結晶化するため,観察の邪魔になります.
そこで,⑤水ですすいでやります.
極力ハイターを取り除き,洗瓶で純粋を注入.

⑥ピペットで水を吸い出す操作を2-3回繰り返します.
⑦水分をなるべく取り除いた後は,乾燥するまで待ちます.
最後に,水の代わりにエタノールですすぐと乾燥が早くなります.

ピンセットで,骨片を両面テープに張り付けて完成
あとはSEMで観察するのみです